Nrf2 protege las Mitocondrias
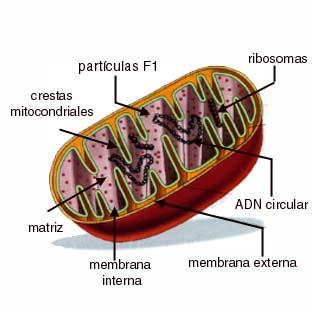
Los niveles subletales de estrés oxidativo generalmente se asocian con diferentes condiciones fisiopatológicas. Los cardiomiocitos tienen el contenido máximo de mitocondrias entre todos los tipos de células, lo que permite el análisis de las mitocondrias en las células que sobreviven al estrés oxidativo e investigar si Nrf2 puede deshacer esos cambios. Las mitocondrias normalmente existen en sistemas muy complejos, que han sido sustituidos por mitocondrias puntuales individuales 24 horas después de la exposición a una dosis no letal de H2O2. El microscópio de electrones demostró que las células que residen en H2O2 revelan hinchazón de las mitocondrias con crestas abarrotadas y regiones de condensación. Las mediciones de mitocondrias funcionales revelaron una reducción dependiente de la dosis de H2O2 durante un lapso de 5 días.
En los niveles de proteína y ARNm, las células que residen en el tratamiento con H2O2 revelan una disminución de los elementos mitocondriales, el citocromo c y el citocromo b. La sobreexpresión de Nrf2 evitó que el H2O2 causara alteraciones morfológicas de las mitocondrias y disminución del citocromo b / c.
Aunque Nrf2 se conoce como un factor de transcripción que regula la desintoxicación y las enzimas antioxidantes, la sobreexpresión de Nrf2 no redujo significativamente el grado de oxidación de proteína. Más bien, se encontró que Nrf2 se conectaba con la membrana mitocondrial externa. Nuestros datos implican que Nrf2 protege las mitocondrias de la lesión oxidante probablemente a través de la interacción directa con las mitocondrias. Se encontró una cantidad elevada de estrés oxidativo junto con una variedad de dolencias cardíacas, especialmente infarto de miocardio (IM). Infarto de miocardio, más comúnmente causado por la congestión de la arteria coronaria, que causa una función metabólica disminuida de las mitocondrias y la inactivación del superóxido dismutasa y el glutatión peroxidasa, lo que conduce a un elevado grado de H2O2 en el área isquémica del miocardio.
Con animales experimentales, la concentración de H2O2 alcanza 4 a 6 μM en el corazón. Aunque la tecnología médica actual permite el rescate rápido de la isquemia a partir de la intervención coronaria percutánea basada en la angioplastia, aproximadamente el 35 por ciento de los individuos se someten a un trauma miocárdico periprocedimiento y tienen un mayor riesgo de infarto de miocardio posterior. Esto se refiere a cómo la reperfusión mejora la producción nítrica a través de la función adrenal anormal además de la activación de la xantina oxidasa.
La isquemia viva y la reperfusión del miocardio se someten a remodelación y reparación, enraizadas en las modificaciones que ocurren a nivel molecular y celular. Aunque las mitocondrias se han estudiado ampliamente como una forma importante de muerte celular, la función de las mitocondrias en las células que sobreviven al estrés oxidativo aún no se ha abordado.
Las células de mamíferos contienen mecanismos de defensa innata que son efectivos para resistir el daño y promover la supervivencia celular. Mientras que los oxidantes a niveles elevados pueden dañar el sistema inmune, dañar las macromoléculas y finalmente conducir a la muerte celular, casi todas las células pueden soportar dosis reducidas a moderadas de oxidantes.
Hemos descubierto que los cardiomiocitos que habitan en el estrés oxidativo más tarde crean hipertrofia, junto con el tamaño de las células expandidas, mayor contenido de proteínas y la expresión de biomarcadores de insuficiencia cardíaca. A menudo se entiende que Nrf2 se transloca en el núcleo tras la activación por ansiedad oxidativa o electrofílica, en la que Nrf2 se une al elemento de respuesta antioxidante en el promotor de numerosas enzimas antioxidantes y de desintoxicación, como superóxido dismutasa 1, glutatión transferasas, glutamato cisteína ligasa y hemo oxigenasa-1 (HO-1).

Nrf2 y la protección mitocondrial
Nrf2 y su función citoprotectora
Se demostró que la sobreexpresión de Nrf2 era citoprotectora en numerosas células, mientras que la desactivación (KO) de Nrf2 aumentaba la sensibilidad a las lesiones tisulares.
Independientemente de cómo muchos tipos de lesiones tisulares implican daño a las mitocondrias, el hecho de que Nrf2 protege las mitocondrias del daño aún no se confirma o no se conoce. Los cardiomiocitos contienen el contenido máximo de mitocondrias entre todos los tipos móviles, ofreciendo un método experimental legítimo para examinar la reacción de las mitocondrias durante la supervivencia celular. Aquí abordamos el efecto del estrés oxidativo sobre las mitocondrias en cardiomiocitos y si la altitud de Nrf2 funciona para proteger a las mitocondrias de los cardiomiocitos.
Fuente: https://www.fasebj.org/doi/full/10.1096/fj.14-268904

Comentarios recientes